Cтроение атома и электронные оболочки
Первое задание в ОГЭ по химии проверяет знания в области строения атома и строения электронных оболочек атомов первых 20 элементов Периодической системы Менделеева. Поэтому для успешного решения первого задания нам потребуются знания в этой области. Что же нам необходимо знать?
Теория к заданию №1 ОГЭ по химии
Все атомы состоят из ядра и электронной оболочки. Ядро поэтому так и называется, так как оно расположено в самом центре и очень-очень маленькое. Ядро заряжено положительно. Положительный заряд ядру придают протоны - положительно заряженные элементарные частицы. Один протон несет в себе заряд +1. Таким образом, сколько в ядре протонов, таков и заряд ядра. Заряд ядра, а следовательно и количество протонов показывает нам порядковый номер элемента в таблице Менделеева. Если порядковый номер 2, то заряд ядра равен двум - это ядро гелия - второго элемента в периодической таблице.
Порядковый номер элемента показывает также и количество электронов в электронной оболочке. Электронная оболочка окружает ядро и компенсирует положительный заряд ядра отрицательными зарядами электронов. Более того, электронная оболочка обуславливает протекания всех химических реакций - именно изменение состава электронной оболочки и её конфигураций объясняет природу химических реакций. Как и ядро, оболочка состоит из элементарных частиц - электронов. Электроны, в отличии от протонов, несут заряд -1 - электронная оболочка заряжена отрицательно. Но кроме этого, есть еще одно важное отличие электрона от протона - протон имеет вес 1, а электрон не имеет веса (на самом деле это не так, но для решения задач нам не понадобятся знания о массах элементарных частиц).
Кроме протонов, в ядре содержатся нейтроны - незаряженные элементарные частицы с массой 1. Они придают только вес атому и ядру, но не заряд. Количество нейтронов можно найти, зная массу элемента и его порядковый номер, так как порядковый номер показывает количество протонов и их суммарную массу, а молекулярная масса - общую массу. Таким образом, вычитая из общей массы массу протонов, мы получаем количество нейтронов.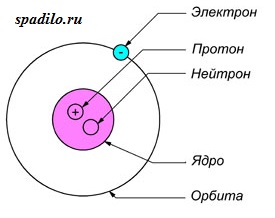
Суммарный заряд атома нейтрален, отсюда следует, что количество протонов равно количеству электронов.
Электроны в оболочке расположены упорядочено - слоями. Количество слое определяет номер периода в периодической таблице.
Число слоев определяется номер периода, в котором стоит элемент.
В первом периоде может быть максимально два электрона, во втором - восемь, в третьем - восемь. Заполнение электронных оболочек первых трех периодов идет постепенно - сначала полностью заполняется первый, потом полностью второй и третий.
Число свободных неспаренных электронов определяется по формуле 8-n, где n – номер группы, в которой стоит химический элемент.
На этом теоретический экскурс окончен и мы можем приступить к разбору типовых заданий.
Разбор типовых вариантов заданий №1 ОГЭ по химии
Первый вариант задания
В атоме калия распределение электронов по электронным слоям соответствует ряду чисел:
- 2; 8; 6; 3
- 8; 8; 2; 2
- 2; 8; 1
- 2; 8; 8; 1
Так как элемент калий стоит в 4-м периоде, в главной подгруппе 1-ой группе, его порядковый номер 19. Следовательно, 19 электронов распределены по 4-м слоям. На первом слое 2 электрона, на втором 8, на третьем восемь, и на четвертый остается один, значит схема строения:
2; 8; 8; 1
Ответ: 4
Второй вариант задания
Сколько электронов содержит атом алюминия?
- 27
- 13
- 14
- 3
У алюминия порядковый номер 13, а значит и электронов у него 13.
Ответ: 2
Третий вариант задания
Число протонов в атоме равно
- числу электронов
- относительной атомной массе
- числу нейтронов
- заполненных электронных слоев
Из вышеизложенного мною материала количество протонов равно количеству электронов.
Ответ: 1
Четвертый вариант задания
Число заполняющихся электронных слоёв в атоме равно
- порядковому номеру элемента
- номеру группы
- заряду ядра атома
- номеру периода
Число заполняющихся электронных слоев равно номеру периода.
Ответ: 4
Пятый вариант задания
Для элементов главных подгрупп число электронов во внешнем электронном слое атома равно
- числу нейтронов
- номеру периода
- заряду ядра атома
- номеру группы
В главных подгруппах (знаки элементов стоят слева в ячейке таблицы) число электронов во внешнем слое равно номеру группы.
Ответ: 4
Шестой вариант задания
Атомы азота и фтора имеют одинаковое
- значение радиусов атомов
- значение зарядов ядер атомов
- число электронов во внешнем электронном слое
- число заполненных электронных слоёв
Так как азот и фтор стоят в одном периоде, значит у них одинаковое число электронных слоев. К слову, не бывает разных элементов с одинаковыми радиусами атомов, значениями зарядов ядер.
Ответ: 4
Седьмой вариант задания
Атомы углерода и кремния имеют одинаковое
- число нейтронов в ядре атома
- значение относительной атомной массы
- число протонов в ядре атома
- число валентных электронов
Так как углерод и кремний находятся в одной группе (четвертой), то у них одинаковое число валентных электронов.
Ответ: 4
Восьмой вариант задания
Схема распределения электронов по электронным слоям 2, 8, 7 соответствует атому
- хлора
- фтора
- кислорода
- серы
Суммарное число электронов:
2 + 8 + 7 = 17
Находим 17 элемент - это хлор.
Ответ: 1
Спасибо
спасибо, все очень понятно
Спасибо большое
Спасибо!!! Всё понятно…
Спасибо большое. Все очень понятно и доступно объяснено.
Спасибо,2 задания встретились мне впервые)
Спасибо огромное!
Спасибо большое!!! Очень долго искала сайт где есть теория к заданию…
Огромное спасибо! Теперь я точно вытяну на 4
Спасибо,очень понятно всё и доступно.