Классификация веществ
Перейдем к рассмотрению задания №5 в ОГЭ по химии или А5. Данный вопрос посвящен классификации веществ в химии, в нем рассматриваются основные классы неорганических веществ и номенклатура. Вопрос довольно ёмкий, поэтому я составил схемы, которые будут способствовать лучшему понимаю.
Теория к заданию №5 ОГЭ по химии
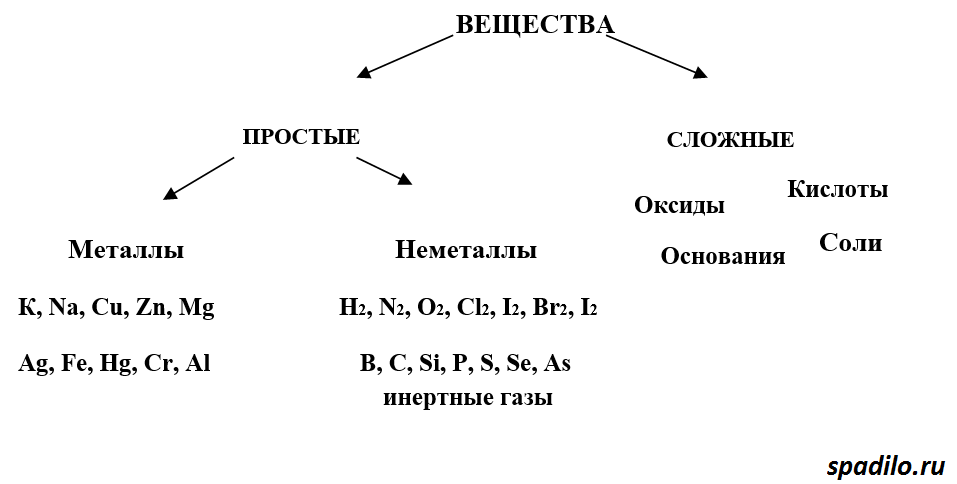
Итак, как мы уже с Вами разобрали в предыдущем вопросе А3, вещества бывают простые и сложные. Простые состоят из атомов одного элемента - сложные из атомов различных элементов. Простые вещества в свою очередь делятся на металлы и неметаллы. У сложных веществ больше классов - оксиды, кислоты, основания, щелочи.
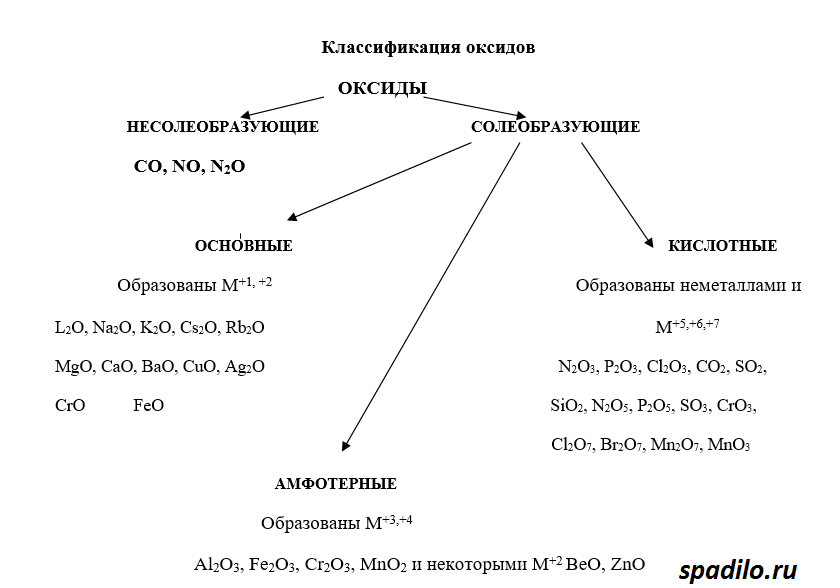
Классификация оксидов
Рассмотрим классификацию оксидов. Оксиды - это соединения кислорода с другими элементами. В зависимости от того, с каким элементом кислород образует соединение, оксиды делятся на основные, кислотные и амфотерные.
- Основные оксиды образуют металлы в степенях окисления +1 и +2 (K2O, MgO)
- Кислотные оксиды образуют преимущественно неметаллы (SO3, N2O5)
- Металлы Zn и Al образуют амфотерные оксиды (ZnO, Al2O3)
Из всех правил есть исключения, но о них в другой раз. К тому же в ОГЭ и ЕГЭ данные исключения не фигурируют.
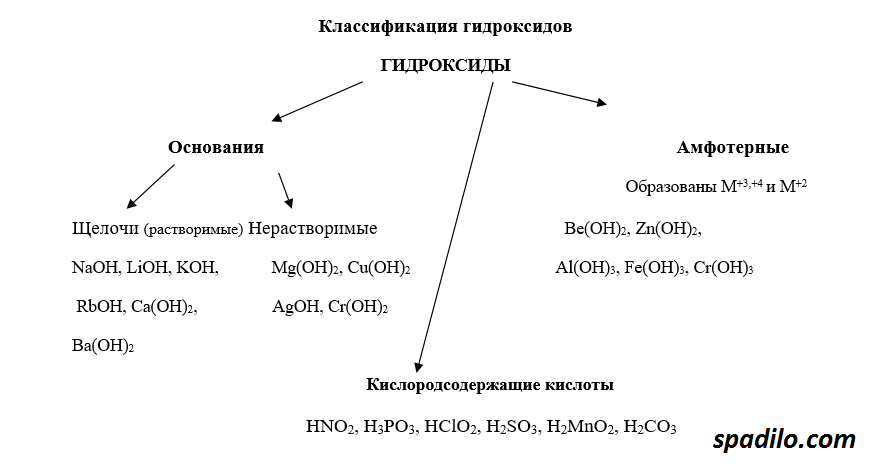
Классификация гидроксидов
Гидроксиды - продукты соединения оксидов с водой. В зависимости от того, какой был оксид, гидроксиды делятся на основания, кислоты и амфотерные основания. Основные оксиды образуют основания, кислотные, соответственно, кислоты, амфотерные оксиды образуют амфотерные основания - вещества, проявляющие свойства и кислот и оснований. В свою очередь основания делятся на растворимые - щелочи, и нерастворимые.
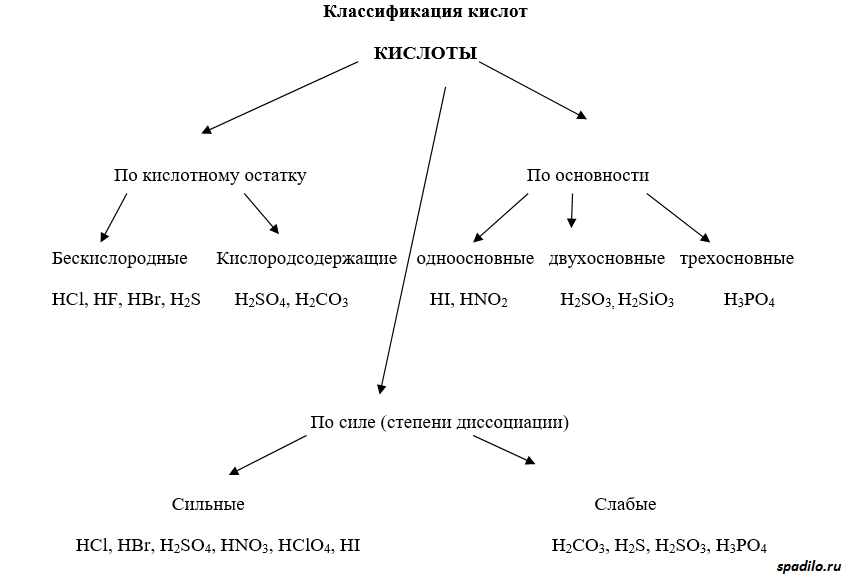
Классификация кислот
Кислоты имеют различные классификации. Существуют кислородсодержащие и бескислородные кислоты. Отличие первых от вторых состоит в том, что первые содержат в своей молекуле кислород, а вторые состоят только из элемента и водорода (HCl, например). Бескислородные кислоты образуются непосредственно при взаимодействии элемента (Cl2) и водорода (H2), в то время как кислородсодержащие кислоты образуются взаимодействием оксидов с водой.
Классификация по основности подразумевает количество протонов, отдаваемое молекулой кислоты при полной диссоциации. Одноосновные кислоты диссоциируют с образованием одного протона, двухосновные - двух, и так далее.
Классификация по степени диссоциации показывает, насколько легко проходит диссоциация (отрыв протона от молекулы кислоты). В зависимости от этого различают сильные и слабые кислоты.
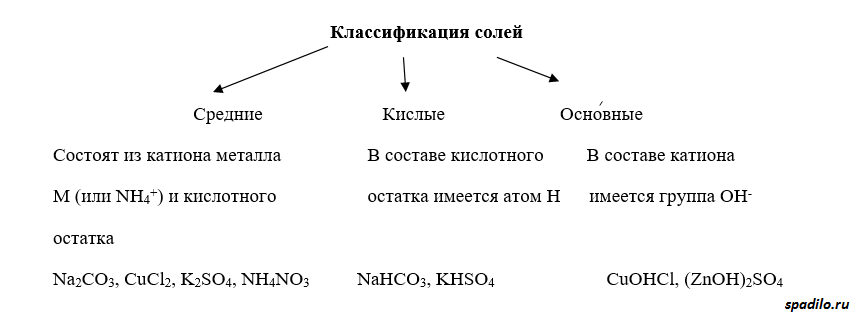
Классификация солей
Соли делятся на средние, кислые и основные. В кислых солях присутствует протон, в основных - гидрокси-группа. Кислые соли представляют собой продукт взаимодействия избытка кислоты с основанием, основные соли - наоборот - продукт взаимодействия избытка основания с кислотой.
Подведем небольшой итог по пройденной теме.
- Оксиды – сложные вещества, состоящие из двух химических элементов, один из которых - кислород.
- Основания – это сложные вещества, состоящие из ионов металла и гидроксид-ионов.
- Кислоты – это сложные вещества, состоящие из ионов водорода и кислотных остатков.
- Соли – это сложные вещества, состоящие из ионов металла и кислотных остатков.
Разбор типовых вариантов задания №5 ОГЭ по химии
Первый вариант задания
Гидроксиду натрия соответствует формула
- NaH
- NaOH
- NaHCO3
- Na2CO3
Решение.
Рассмотрим каждый случай. NaH представляет собой соединение металла натрия с водородом - такие соединения носят названия гидриды, но не гидроксиды. NaOH образовано катионом металла - натрия и гидроксо- группой. Это и является гидроксидом натрия согласно классификации. NaHCO3 - кислая соль - гидрокарбонат натрия. Она образована остатком угольной кислоты и катионом натрия. Na2CO3 - средняя соль - карбонат натрия.
Ответ: 2.
Всё очень хорошо объяснено, но только одно задание. Нужно больше практики(
Обязательно добавим!
спасибо! очень понятное объяснение
Александра, записывайтесь на наши бесплатные вебинары по подготовке к ОГЭ по химии! Будет еще понятней!
В прошлом уроке было написано, что валентность пишется данными цифрами:»I,II,III,IV,V и т.д.», но в вашем уроке написано, что кислотные оксиды образуются с металлами с валетностью +3, +4. Исправьте.
Спасибо, подправили!