[su_box title=»Описание задания» style=»soft» box_color=»#c1e8cc» title_color=»#0c0a0a»]
В Задании №1 нам необходимо уметь хорошо пользоваться таблицей Менделеева. Первое задание — это поиск атома или иона с заданной конфигурацией электронов, обычно это количество электронов на внешнем уровне (соответствует номеру группы).
Тематика заданий: электронная конфигурация атомов
Бал: 1
Сложность задания: ♦◊◊
Примерное время выполнения: 1 мин.
[/su_box]
Разбор типовых вариантов заданий №1 ЕГЭ по химии
Вариант 1ЕХ1
[su_note note_color=»#defae6″]
Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне пять электронов.
- P
- N
- S
- Al
- O
[/su_note]
Данный пример — типичный вариант первого задания — необходимо определить количество электронов на внешнем уровне. Вспоминаем, что на количество электронов на внешнем уровне указывает номер ГРУППЫ:
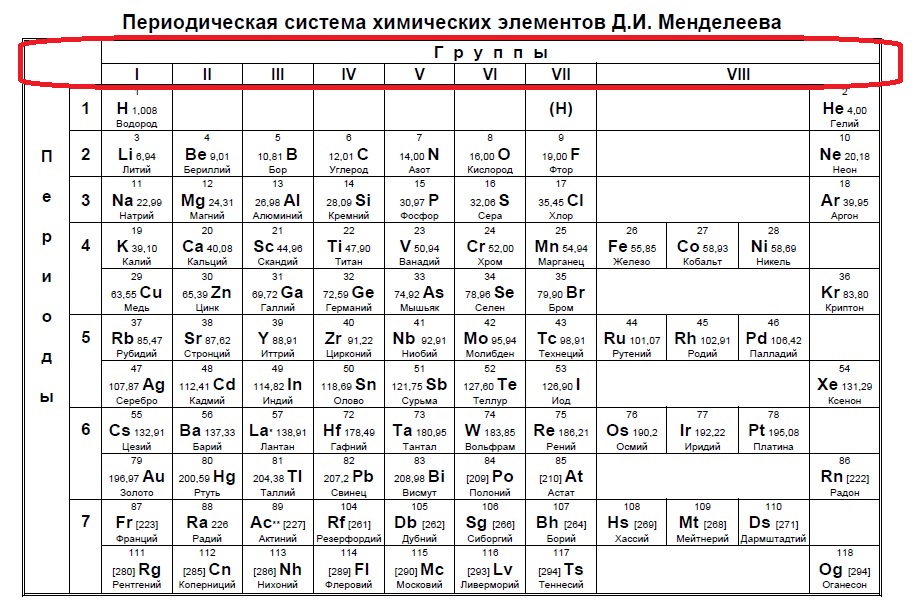
Напомню, что нам важно обращать внимание на то, в главной или побочной группе находится элемент. К сожалению, в таблице, которая дана на ЕГЭ нет деления на главные или побочные группы (какие-то элементы пишут правее, какие-то левее, но это не деление на главные и побочные группы), данная таблица не удобна, однако, по правилам можно пользоваться только ей. Обсуждать недостатки данной таблицы мы не будем, скажем лишь, что в условиях задания представлены всегда элементы главных групп, поэтому данный вопрос отпадает сам собой на экзамене (но нет гарантий, что не могут дать определить количество внешних электронов у кобальта, например, по номеру группы в данной таблице это не определишь).
Итак, находим наши пять элементов из условия:
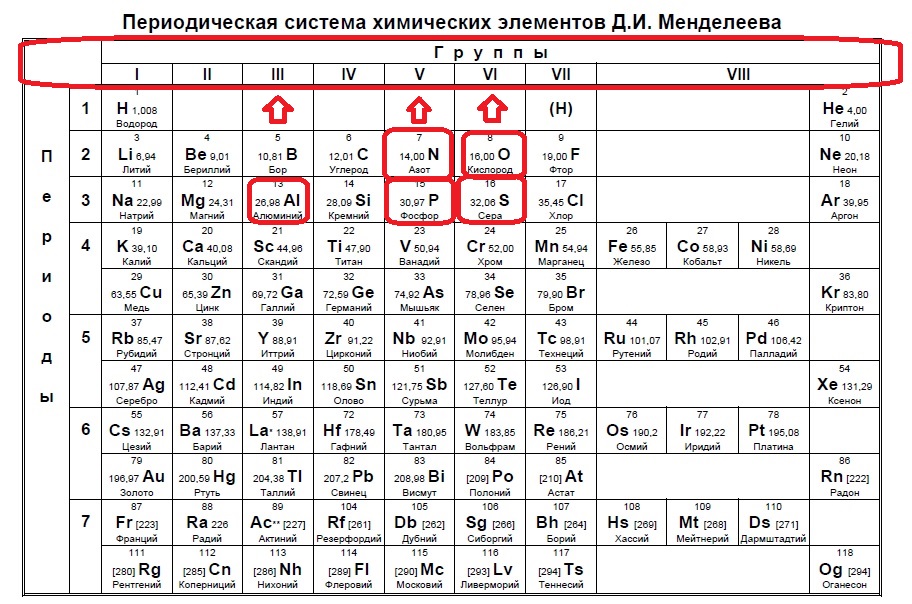
Определяем номер группы — у алюминия 3 группа, у азота и фосфора — пятая, у кислорода и серы — шестая.
В условии нас спрашивают про пять электронов — значит выбираем элементы из пятой группы — азот и фосфор!
Ответ: 12
Вариант 1ЕХ2
[su_note note_color=»#defae6″]
Определите, двум атомам каких из указанных элементов до завершения внешнего уровня не хватает шести электронов.
- Ba
- At
- Bi
- Mg
- Cs
[/su_note]
Данное задание немного другого типа, в нем необходимо определить элементы, которым не хватает какого-то количества электронов до завершения внешнего уровня. В этом случае наш алгоритм прост: мы знаем, что на внешнем уровне должно быть 8 электронов (2 и 3 период, или главные группы 4,5,6.. — в заданиях в основном фигурируют именно эти элементы), а значит вычитаем из 8 заданное число — в нашем случае 6: 8-6=2. Значит, в нашем элементе должно быть два электрона на внешнем уровне и, следовательно, расположен он во второй группе. Определяем группы элементов из условия:
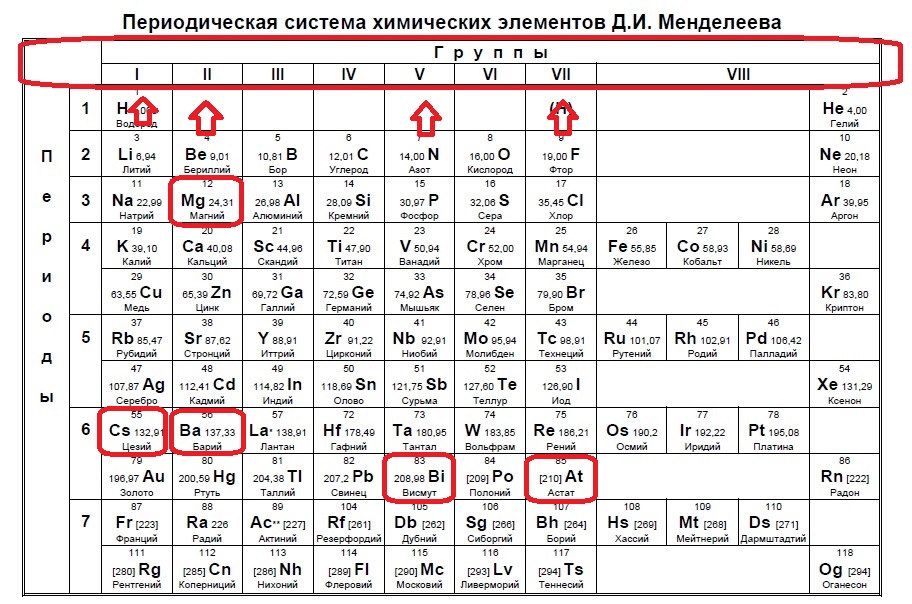
В данном случае элементы второй группы — магний и барий.
Ответ: 14
Вариант 1ЕХ3
[su_note note_color=»#defae6″]
Определите, атомы каких двух из указанных в ряду элементов в основном состоянии содержат один неспаренный электрон.
- S
- Na
- Al
- Si
- Mg
[/su_note]
Следующий вид задания на поиск элементов с неспаренным электроном. Тут все достаточно просто. Так как электроны у нас в орбиталях всегда располагаются по парам (если помните, то есть квадратик, в котором мы рисуем стрелочку вверх и низ), то логично, что неспаренный электрон образуется, когда количество электронов на внешнем уровне нечетно, то есть в элемент должен быть расположен в нечетной группе, а именно 1,3,5,7. Определяем группы указанных нам элементов:
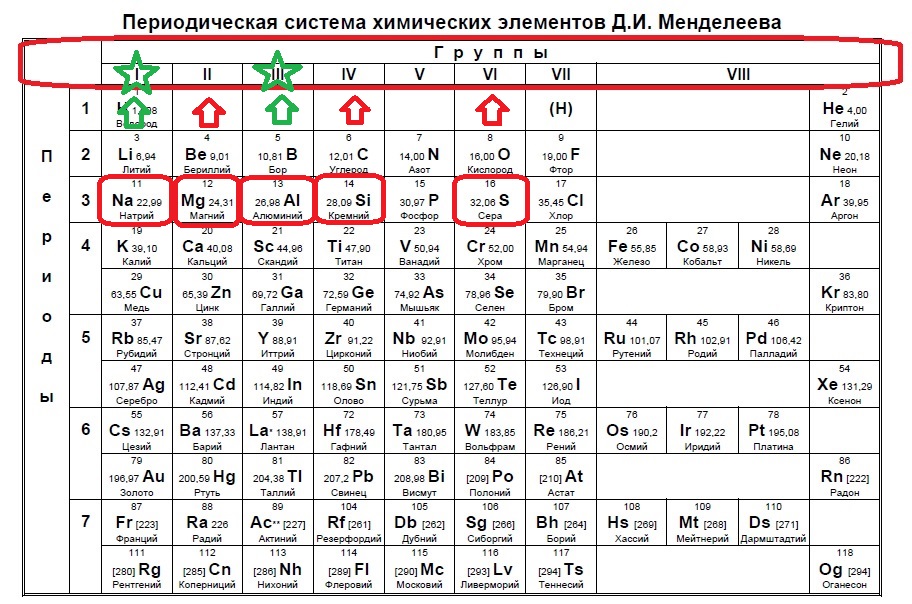
Итак, натрий в первой группе, магний во второй, алюминий в третьей, кремний в четвертой, а сера в шестой.
Выбираем элементы в нечетных группах — это натрий и алюминий!
Ответ: 23
Вариант 1ЕХ4
[su_note note_color=»#defae6″]
Определите, атомы каких двух из указанных в ряду элементов в основном состоянии содержат два неспаренных электрона.
- S
- Mg
- C
- B
- Li
[/su_note]
В данном задании нужно найти два неспаренных электрона. Данное распределение можно найти, начиная с p-подуровня, а именно два неспаренных электрона образуются в четвертой группе, так как на s -подуровне два электрона + 2 должно быть на p-подуровне, и в шестой группе, где 2s+2p(спаренные)+2p(неспаренные) (так как в p-подуровне три орбитали по два электрона на каждой). Таким образом нужно найти элементы четвертой группы или шестой:
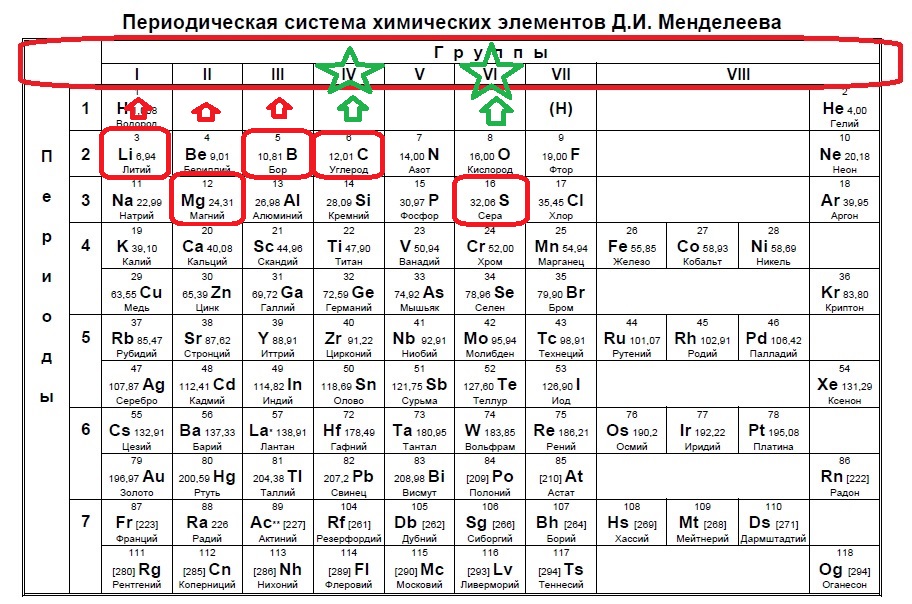
В нашем случае это углерод и сера.
Ответ: 13
Вариант 1ЕХ5
[su_note note_color=»#defae6″]
Определите, какие два из указанных элементов образуют устойчивый положительный ион, содержащий 10 электронов.
- Na
- K
- N
- Li
- Al
[/su_note]
В данном варианте задания речь идет уже об ионе, причем положительном, который содержит 10 электронов. В такого вида заданиях необходимо определить, сколько заполнено уровней у иона в зависимости от количества электронов. В нашем случае 10 электронов — это полностью заполненные первый (2) и второй (8) уровни (или периоды в таблице). Так мы говорим о положительном ионе — значит элемент потерял электроны, но у него их было больше чем 10, а значит, он расположен в третьем периоде. Ищем такие элементы:
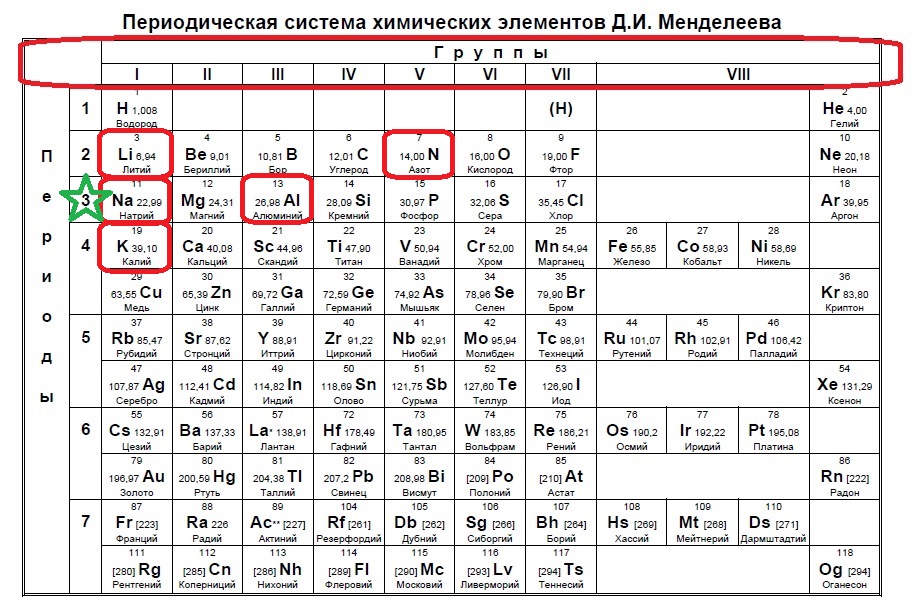
Нам подходят натрий и алюминий.
Ответ: 15
Вариант 1ЕХ6
[su_note note_color=»#defae6″]
Определите, какие из указанных элементов образуют устойчивый отрицательный ион, содержащий 18 электронов.
- N
- Al
- S
- Cl
- Ca
[/su_note]
Отрицательный ион получается путем добавления электронов к атому. 18 электронов — это полностью заполненный третий уровень или период, значит, наши элементы расположены именно в нем (в отличии от предыдущего задания, где мы искали в следующем периоде, так как ион положительный). Смотрим на предоставленные в условии элементы:
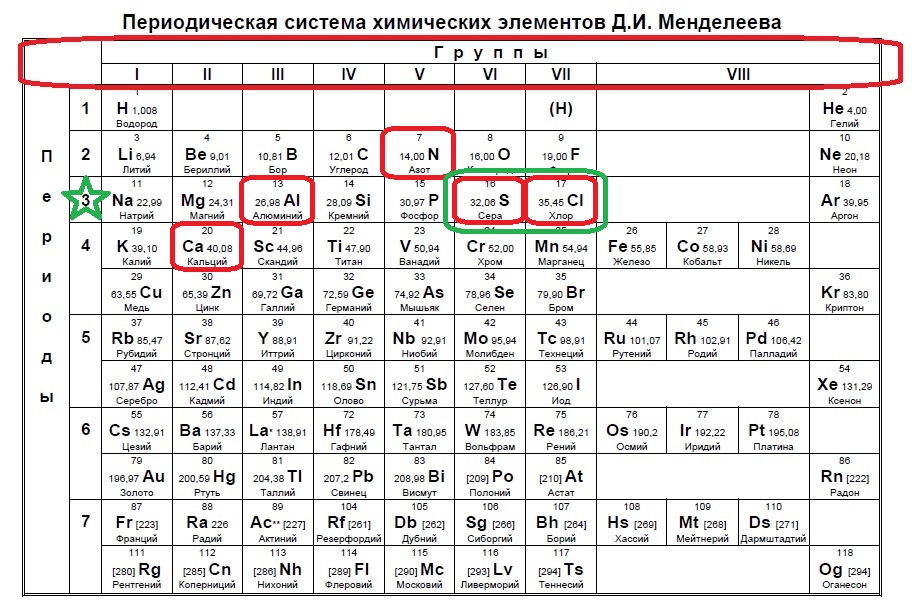
В данном случае в третий период попали алюминий, сера и хлор. Алюминий не может принять электроны до 18, так как является металлом и отдает электроны. Наиболее типичные элементы-любители электронов расположены правее. Это сера и хлор для данного задания.
Ответ: 34
Вариант 1ЕХ7
[su_note note_color=»#defae6″]
Определите, какие из указанных элементов на внешнем уровне содержат больше s-электронов, чем p-электронов (в основном состоянии).
- H
- C
- F
- Be
- P
[/su_note]
Такие виды заданий часто встречаются в тренировочных вариантах, нужно либо определить кого меньше, когда равно или кого больше. Разберем для наглядности данный пример. s-электронов всего два, значит p-электронов должно быть 1, чтобы было меньше. В сумме у элемента на внешнем уровне получается максимум 3 электрона (но может быть и ноль p-электронов и один или два s!), а значит он в третьей, второй или первой группе:
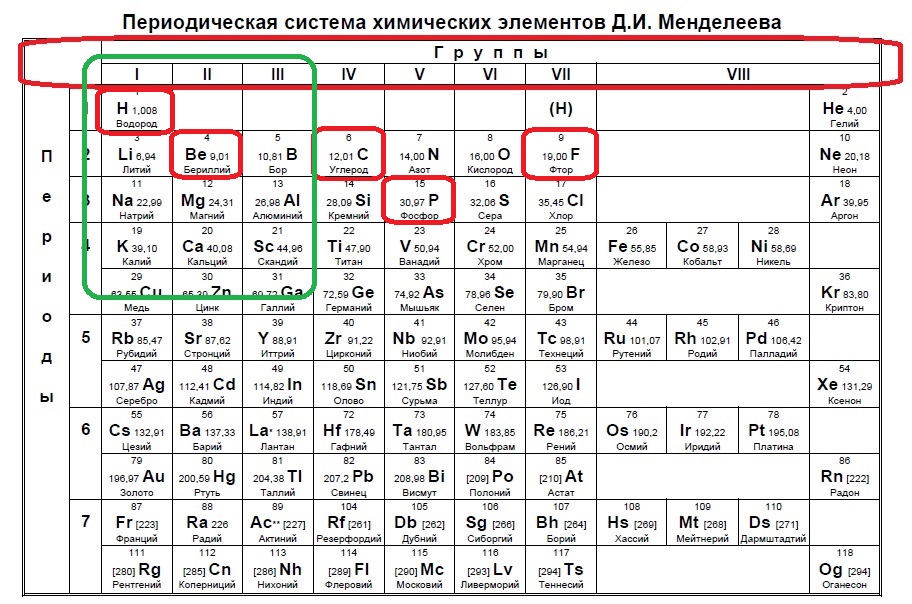
Нам подходит водород и бериллий.
Ответ: 14.
Остальные задания очень похожи на разобранные, поэтому вы их точно сможете решить, разобравшись с выше представленными решениями.