Степень окисления химических элементов. Окислитель и восстановитель. ОВР.
В 14 задании нам потребуются знания об окислении и восстановлении, понятия окислитель и восстановитель, окислительно-восстановительная реакция.
Теория к заданию №14 ОГЭ по химии
Степень окисления - условная величина, показывающая заряд атома в молекуле.
Степень окисления никогда не показывает реальный заряд атома - это условная величина, принимаемая нами для удобства рассчетов химических реакций.
Чтобы определить степень окисления атома в молекуле, следует пользоваться следующими правилами:
- степень окисления водорода всегда +1 (исключение - гидриды металлов)
- степень окисления кислорода всегда -2 (исключения - пероксиды и фториды)
- степень окисления металлов первой группы +1, второй +2, алюминия +3
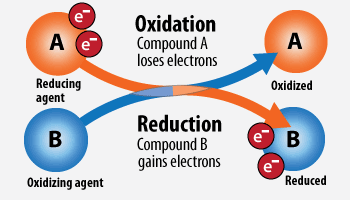
Окислитель - это атом или ион в молекуле, который забирает электроны.
Восстановитель - это атом или ион в молекуле, который отдает электроны.
Окислитель в ходе реакции восстанавливается, а восстановитель наоборот - окисляется!
- кислоты: HNO3, H2SO4, HClO4, H2Cr2O7
- соли: KСlO4, KClO3, KNO3, KMnO4, K2Cr2O7
- оксиды: PbO2, Mn2O7, CrO3, N2O5
- активные неметаллы – фтор, хлор, кислород, озон
- металлы
- вещества с минимально возможной (отрицательной) степенью окисления неметалла
- водородные соединения: NН3, HI, HBr, H2S
- соли: KI, NaBr, K2S
Составление окислительно-восстановительной реакции (ОВР)
Основное правило, которым мы должны руководствоваться при составлении ОВР:
Количество электронов, отданное восстановителем, равно количеству электронов, принятых окислителем.
Именно этот факт позволяет уравнять химическую реакцию.
Разбор типовых вариантов задания №14 ОГЭ по химии
Первый вариант задания
Сера является окислителем в реакции:
- H2S + I2 = S + 2HI
- 3S + 2Al = Al2S3
- 2SO2 + О2 = 2SO3
- S + 3NO2 = SO3 + 3NO
Распишем первое уравнение:
H2S + I2 = S + 2HI
Исходные вещества:
- степень окисления серы в молекуле сероводорода равен -2, так как водород всегда +1
- степень окисления йода 0, так как это простое вещество
Продукты реакции:
- степень окисления серы 0, простое вещество
- степень окисления йода -1, так как водород +1
Анализируем:
- сера поменяла степень окисления с -2 до 0, значит отдала электроны (целых два на один атом :-)) - значит она восстановитель (но сама сера окислилась!)
- йод поменял степень окисления с 0 до -1, значит он принял электроны - окислитель (но сам по себе йод восстановился!)
Перейдем ко второй реакции:
3S + 2Al = Al2S3
Исходные вещества:
- степень окисления серы 0, простое вещество
- степень окисления алюминия 0, так как это тоже простое вещество
Поскольку реагирует металл и неметалл, то можно сразу понять, что металл восстановитель, а неметалл - окислитель и это верный ответ, но мы продолжим разбор 😉
Продукты реакции:
- степень окисления алюминия (из моих правил вверху) +3
- степень окисления серы -2
Анализируем:
- сера из нулевой степени окисления стала -2, значит забрала электроны и восстановилась, но сама сера - окислитель
- алюминий отдал электроны и окислился - он восстановитель
Третья реакция:
2SO2 + О2 = 2SO3
Исходные вещества:
- степень окисления серы +4, так как у кислорода заряд -2, и их два атома
- степень окисления кислорода 0, так как это простое вещество
Поскольку реагирует кислород и образуется оксид, можно догадаться, что сера здесь выступает восстановителем и окисляется, докажем это:
Продукты реакции:
- степень окисления серы +6
- степень окисления кислорода -2
Анализируем:
- сера отдала последние два электрона и окислилась, являясь восстановителем
- кислород забрал электроны и восстановился, являясь окислителем
Последняя реакция:
S + 3NO2 = SO3 + 3NO
Исходные вещества:
- степень окисления серы 0, так как это простое вещество
- степень окисления азота +4, так как у кислорода -2, и их два атома
Продукты реакции:
- степень окисления серы +6, так как у кислорода степень окисления -2, и их три атома в молекуле
- степень окисления азота +2, так как у кислорода -2
Анализируем:
- сера отдала 6 электронов и окислилась, являясь восстановителем
- азот забрал электроны (+4 -> +2) и восстановился, являясь окислителем
Ответ: 2
извините, в 14 задании огэ по химии отсутствуют еще варианты заданий , которые могут попасться на огэ