Реакции ионного обмена
Перейдем к рассмотрению реакций ионного обмена в задании №8 ОГЭ по химии, или А8. Тематика задания сформулирована следующим образом:
- реакции ионного обмена
- условия их осуществления
Теория к заданию №8 ОГЭ по химии
Итак, начнем с определений:
Реакция ионного обмена - одна из видов химических реакций, продуктами которой являются вода, газ или осадок.
Иначе говоря, вещества обмениваются ионами только тогда, когда образуется либо газ, покидающий реакционную смесь, либо малорастворимое вещество - осадок или вода. Более профессиональным языком можно сказать, что движущей силой реакции ионного обмена является образование продукта иного агрегатного или фазового состояния в сравнении с реагентами.
На практике чаще всего мы сталкиваемся с реакциями в растворах, в результате которых образуется осадок, либо газ, либо вода. Чаще всего это реакции обмена.
Пример - реакция карбоната натрия и серной кислоты с выделением углекислого газа:
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ +H2O
В ионом виде:
2Na+ + CO32- + 2H+ + SO42- → 2Na+ + SO42- + CO2↑ + H2O
В сокращенном ионном виде:
CO32- + 2H+ → CO2↑ + H2O
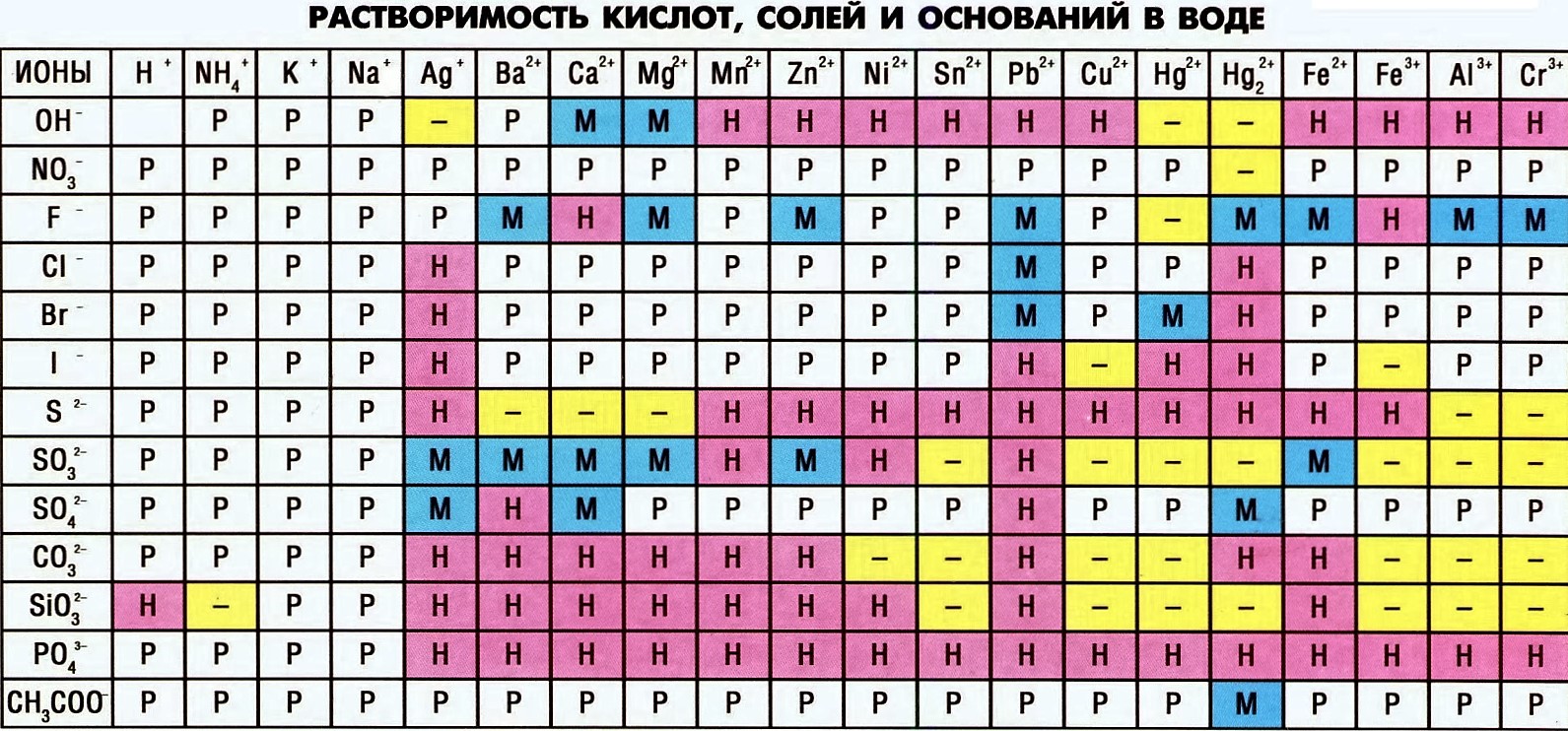
Для успешного решения задач нам необходимо запомнить следующие правила:
- используем таблицу растворимости: если видим, что продукт (то, что слева в уравнении) нерастворим, то реакция идет.
- если видим в левой части газ (CO2, H2S, SO2 - типичные для ионного обмена), реакция идет.
- если видим воду (H2O), реакция идет.
Разбор типовых вариантов задания №8 ОГЭ по химии
Первый вариант задания
Газ выделяется при взаимодействии
- MgCl2 и Ba(NO3)2
- Na2CO3 и CaCl2
- NH4Cl и NaOH
- CuSO4 и KOH
Рассмотрим каждый случай.
MgCl2 + Ba(NO3)2 = Mg(NO3)2 + BaCl2
Смотрим в таблицу растворимости: нитрат магния растворим (кстати, как и все нитраты), хлорид бария - тоже, поэтому реакция не идет. Это во-первых, а во-вторых, нас спрашивают про газ, а газом здесь и не пахнет. 🙂
Na2CO3 + CaCl2 = 2 NaCl + CaCO3
Карбонат кальция нерастворим, реакция ионного обмена идет, но газа в продуктах в ней нет, поэтому этот вариант нам не подходит.
NH4Cl + NaOH = NH4OH + NaCl
NH4OH можно записать как NH3 и H2O, особенно актуально это для щелочной среды, в ней всегда выделяется аммиак!
NH4Cl + NaOH = NH3 + H2O + NaCl
Аммиак - газ, да еще и ядовитый, поэтому этот вариант нам подходит.
CuSO4 + 2 KOH = Cu(OH)2 + K2SO4
Гидроксид меди нерастворим, но газа здесь не наблюдается.
Ответ: 3
а газом здесь и не пахнет… это ты админ четко шутканул ))))0))00)))