Общая информация
ВПР по химии для 11 класса состоит из пятнадцати заданий. 11 из них относятся к базовому уровню сложности, и только 4 – к повышенному. Задания разделяются на 4 блока:
| Блок | Номера заданий |
| Теоретические основы химии | 1-4 |
| Неорганическая химия | 5-10 |
| Органическая химия | 11-14 |
| Методы познания и экспериментальные основы химии; химия и жизнь | 15 |
Для того чтобы написать работу, учащимся дается 90 минут, то есть 2 урока. Во время проведения ВПР по химии одиннадцатиклассникам разрешается иметь при себе следующие вещи:
- Калькулятор (непрограммируемый)
- Периодическая таблица Д. И. Менделеева
- Электрохимический ряд напряжений металлов
- Таблица растворимости
Система оценок
Всего за работу можно набрать 33 балла. Четко определенной шкалы их перевода в оценки не предусмотрено – это осуществляется на усмотрение руководства образовательного учреждения.
Примеры заданий с разбалловкой и пояснениями
Задание 1
Первое задание открывает блок номеров, проверяющих знания учеников в области теоретических основ химии. В начале задается тема задания – например, способы разделения смесей либо методы сбора газа (они перечисляются). Приводится 3 рисунка (без подписей), иллюстрирующих то, о чем идет речь в тексте – к примеру, три способа разделения смесей. Далее нужно соотнести номер рисунка с указанными в задании положениями таблицы, а также – указать то, что иллюстрирует данный рисунок (например, способ или метод). Таблица может выглядеть так:
| Смесь | № рисунка | Способ разделения |
|---|---|---|
| Хлопья ржавчины и водопроводная вода | ||
| Растворимые природные примеси и дождевая вода |
Если вся таблица заполнена верно, ученик получает 2 балла за это задание. Если же в одном из ее элементов есть ошибка – 1 балл, а при наличии 2 и более ошибок – 0 баллов.
Задание 2
Во втором задании проверяются познания одиннадцатиклассников в таких аспектах химии, как состав атома и строение его электронной оболочки. В условии приводится рисунок, на котором изображена модель строения либо схема распределения электронов по уровням какого-либо элемента – например, вот так:
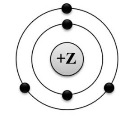
Необходимо дать ответы на три вопроса: написать порядковый номер элемента, номер периода и группы, в которых он располагается, а также определить, к чему относится образуемое элементом простое вещество – к металлам или неметаллам.
Если весь ответ верный – ставится 2 балла, при одной ошибке – 1 балл, при двух и более – 0.
Задание 3
Этот номер предполагает работу с периодической системой Д. И. Менделеева, знание ее закономерностей и свойств элементов. Дается перечень из 4 элементов – например, Si, O, N, P или Si, Al, S, Cl. Нужно расположить их согласно условию – для данных примеров это уменьшение радиусов атомов и усиление кислотных свойств высших оксидов – и записать в ответе в правильном порядке. За верный ответ ученик получает 1 балл, за неверный – 0.
Задание 4
Четвертое задание ВПР по химии связано со строением химических веществ и их свойствами. Приводится таблица, в которой отображены основные свойства веществ молекулярного и ионного строения. Далее необходимо определить, какое строение имеют два приведенных вещества – к примеру, йод и угарный газ или питьевая сода и ацетилен. Если строение обоих веществ определено верно – одиннадцатиклассник получает 2 балла за это задание, если же только одного – 1 балл, и если весь ответ неверен – 0 баллов.
Задание 5
Пятым заданием открывается блок номеров, относящихся к неорганической химии. Оно связано с классификацией неорганических соединений. Приводится таблица; в первых двух ее графах записаны формулы веществ, но пропущены классы, к которым они относятся, а в следующих двух – наоборот. Она может выглядеть таким образом:
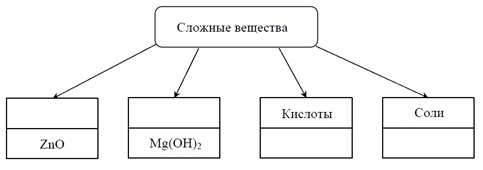
Нужно дополнить таблицу пропущенными элементами. Если это сделано верно – ответ оценивается в 2 балла, если допущена одна ошибка – 1 баллом, если две и больше – 0 баллами.
Далее в тексте работы приводится текст о каком-либо химическом веществе – например, сульфате алюминия или аммиаке. В тексте говорится о способах его получения, внешнем виде, использовании в жизни и промышленности, основных свойствах и реакциях. Задания 6-8, включающие в себя по два вопроса, выполняются с опорой на данный текст. За каждое из заданий 6, 7 и 8 можно получить максимум 2 балла – в случае, если ответ полностью верный. При наличии 1 ошибки ставится 1 балл, и если ответ неверный – 0 баллов.
Задания 6-8
Все эти задания построены по одному принципу – в первой части нужно составить уравнение какой-либо реакции с участием того вещества (или производных от него), о котором говорится в тексте. Все компоненты реакции указаны, также упомянуты другие детали ответа – например, что уравнение должно быть сокращенным либо что оно должно отображать реакцию, происходящую до образования осадка.
К примеру, если текст о сульфате алюминия, первые части вопросов выглядят так:
- Составьте молекулярное уравнение реакции получения сульфата алюминия из оксида алюминия и серной кислоты.
- Составьте молекулярное уравнение реакции между сульфатом алюминия и гидроксидом натрия, протекающей до образования осадка.
- Составьте сокращённое ионное уравнение реакции между гидроксидом алюминия и серной кислотой.
Во второй части задаются вопросы, связанные с записанным уравнением – о типе реакции, о ее признаках, о свойствах полученного вещества. Для нашего примера они выглядят так:
- Опишите признаки протекающей реакции.
- Объясните, почему образующийся осадок растворяется в избытке щёлочи.
- К какому типу реакций (соединения, разложения, замещения, обмена) относится данное взаимодействие?
Задание 9
Девятый номер ВПР по химии, относящийся к повышенному уровню сложности, проверяет умение учащихся работать с окислительно-восстановительными реакциями – составлять их электронные балансы, расставлять коэффициенты и указывать, какое вещество является окислителем, а какое выступает в роли восстановителя. Дается схема реакции – например:
Fe(OH)2 + NaBrO + H2O → Fe(OH)3 + NaBr
или
CH4 + NO2 → CO2 + NO + H2O
Задание состоит из 3 частей. В первой нужно составить электронный баланс, во второй – указать восстановитель/окислитель, а в третьей – расставить коэффициенты. Если все это сделано верно, ответ оценивается в 3 балла, если ученик совершил ошибку в одной части ответа – в 2 балла, в двух частях – 1 балл, и если весь ответ неверен – в 0 баллов.
Задание 10
Десятое задание несколько легче предыдущего, хотя оно также является заданием повышенной трудности. В нем приводится химическая цепочка, обычно включающая в себя три уравнения – к примеру:
K2CO3 → CaCO3 → CO2 → NaHCO3
или
Na2O → NaOH → Na2CO3 → Na2SO4
Требуется составить уравнения реакций. Если все три из них записаны верно – одиннадцатиклассник получает 3 балла, если правильны только два – 2 балла, если только одно – 1 балл, и если все неправильно – 0.
Задание 11
Одиннадцатое задание открывает блок заданий по органической химии. В нем нужно установить соответствие между формулой вещества и его названием, либо между названием вещества и классом/группой, к которой оно относится. Дается три названия либо три формулы, обозначенные буквами, а вот позиций, которые нужно подобрать в соответствие – четыре, поэтому просто подобрать ответ будет сложнее. Ответ записывается в таблицу; если в нем нет ошибок, ставится 2 балла, если одна ошибка – 1 балл, если две-три – 0 баллов.
Задание 12
В условии данного задания приводится две схемы реакций, в которых пропущено по одному веществу. Нужно вставить пропущенные вещества, и, если нужно – расставить коэффициенты. Примеры задания:
.................. + HBr → CH3–CH2–Br + H2O
CH3CH2OH + HCl → .................. + H2O
Если пропущенные элементы записаны верно – ответ оценивается 2 баллами, при одной ошибке – 1 баллом. За неверный ответ либо его отсутствие ученик не получает баллы за это задание.
Задание 13
Тринадцатое задание представляет собой задачу, причем не самую простую – оно относится к повышенному уровню сложности. Чаще всего требуется рассчитать массу какого-либо вещества, иногда дается практический и теоретический выход и недостаток/избыток. Нужно написать уравнение описанной в условии реакции и подробное решение. Приводим примеры условия:
- Рассчитайте, сколько граммов этилацетата можно получить из 600 г уксусной кислоты при 100%-ном практическом выходе.
- Вычислите массу хлорида кальция, который образуется при взаимодействии избытка раствора соляной кислоты с гидроксидом кальция массой 370 г.
Если все сделано правильно – ставится 3 балла, если есть одна ошибка – 2 балла, две ошибки – 1 балл, три и больше – 0.
Задание 14
В предпоследнем задании ВПР по химии, сложность которого также считается повышенной, нужно составить 3 уравнения реакций с органическим веществом. В отличии от задания под номером 10, здесь дается не результат реакций, а оба их компоненты.
Условие выглядит, например, так:
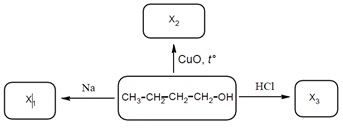
Если все три уравнения правильные, ответ оценивается в 3 балла, если верны только два – в 2 балла, лишь одно -1 балл, ни одного – 0.
Задание 15
Пятнадцатое задание предполагает решение задачи. Чаще всего требуется рассчитать массу или массовую долю. Эта задача легче, чем та, которую надо решать в 13 номере. Примеры:
- Для приготовления маринада в поваренной книге рекомендуется в 500 мл воды растворить 20 г соли, 30 г сахара и 10 г уксусной кислоты. Рассчитайте массовую долю соли и уксусной кислоты в полученном маринаде.
- Для повышения урожайности зелёный лук рекомендуется еженедельно опрыскивать 0,2%-ным раствором аммиачной селитры. Рассчитайте массу аммиачной селитры и массу воды, которые необходимы для приготовления 500 г такого раствора.
Данное задание относится к блоку «химия и жизнь», поэтому в условии задачи описывается практическое применение получаемых веществ. За правильный ответ ученик получает 2 балла, если в ответе есть одна ошибка -1 балл, в иных случаях баллы за задание не присуждаются.