Одним из самых важных открытий в области современной физики стало открытие сложного строения атома. В процессе изучения этого строения были открыты новые законы, которые применимы только для описания движения микрочастиц. Такие законы называют законами квантовой механики.
Строение атома по Томсону
Правильное представление о строении атома сложилось не сразу. Первую модель строения частицы вещества предложил английский физик Дж. Дж. Томсона, которому принадлежит открытие электронов. Сравнить эту модель можно с кексом. Положительный заряд атома, играющий роль теста, занимает весь атомарный объем. Причем его плотность одинакова во всех точках. Электроны, словно изюминки в тесте, равномерно распределяются в объеме, занятом положительным зарядом.

Так, согласно представлениям Томсона, атом водорода представляет собой небольшой положительно заряженный шарик радиусом в 10–10 м. И внутри него расположен один электрон. У более сложных атомов электронов больше.
Опыты Резерфорда
Модель Томсона подверглась критике уже тогда, поскольку она абсолютно противоречила уже открытым к тому времени свойствам атома. Одно из главных свойств — устойчивость.
Известно, что масса электронов в несколько тысяч раз меньше массы атомов. Но в целом атом является нейтральным. Значит, основная масса приходится на его положительно заряженную часть. Для экспериментального исследования распределения положительного заряда, а значит, и массы внутри атома Эрнест Резерфорд предложил в 1906 г. применить зондирование атома с помощью α-частиц. Такие частицы образуются при распаде радия и некоторых других химических элементов. Их масса примерно в 8000 раз больше массы электрона, а положительный заряд равен по модулю удвоенному заряду электрона. По сути, α-частицы — это лишенные электронов атомы гелия. Двигаются они со скоростью, равной 1/15 скорости света.
Такими частицами Резерфорд в своих экспериментах бомбардировал атомы тяжелых элементов. Известно, что электроны неспособны изменить траекторию движения α-частиц, потому что они слишком мало весят. Ведь небольшой камешек, врезавшийся в автомобиль, не может существенно повлиять на его скорость.
Изменить направление движения α-частиц может только положительный заряд атома. Так, если бомбардировать этими частицами атом, то по их рассеянию можно узнать, каким образом распределяется положительный заряд внутри него. Схема опыта резерфорда выглядит так:
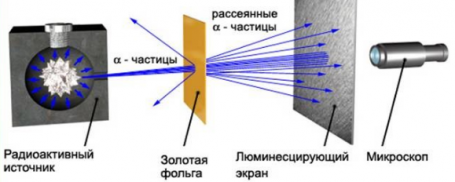
Резерфорд поместил в цилиндр радиоактивное вещество. Вдоль цилиндра ученый высверлил узкий канал, из начал исходить пучок α-частиц. Этот поток попадал на тонкую золотую фольгу. Пройдя ее, частицы попадали на полупрозрачный экран, покрытый сульфидом цинка. За экраном стоял микроскоп, с помощью которого можно было наблюдать столкновение полностью ионизированных атомов гелия с экраном. Ведь при каждом столкновении на экране можно было наблюдать вспышку — сцинтилляцию. Вся установка находилась внутри сосуда, из которого был выкачан воздух — это гарантировало отсутствие других факторов, которые могли бы повлиять на исход опыта.
Если провести опыт без фольги, то глядя в микроскоп, можно было наблюдать следующую картину: на экране формировался кружок, образованный сцинтилляциями от удара α-частиц об экран.

Но если на пути потока этих частиц поставить тонкую фольгу из золота, то картина меняется. Кружок, состоящий из сцинтилляций, становится больше.

Сделав небольшие изменения в установке, Резерфорду удалось обнаружить отклонения α-частиц на большие углы. Для этого он полностью окружил фольгу экранами и подсчитал число вспышек на каждом экране. Совершенно неожиданно оказалось, что некоторое количество α-частиц (примерно одна из двух тысяч) отклонилось на углы, превосходящие 90°. Позднее Резерфорд признался, что, предложив своим ученикам провести эксперимент по наблюдению за рассеянием α-частиц на большие углы, он сам не верил в положительный результат. «Это почти столь же невероятно, — говорил Резерфорд, — как если бы вы выстрелили 15-дюймовым снарядом в кусок тонкой бумаги, а снаряд возвратился бы к вам и нанес вам удар».
Такой результат эксперимента нельзя было предсказать, если считать, что атом действительно имеет такое строение, какое предположил Томсон. Ведь при распределении по всем объему атома положительный заряд не может создать сильное электрическое поле. Поэтому он не смог бы отклонить траекторию движения α-частиц кардинально. Максимальная сила отталкивания в этом случае может быть рассчитана путем применения закона Кулона:
Fmax=kqaqR2
qa — заряд α-частицы, q — положительный заряд атома, R — радиус атома, а k — коэффициент пропорциональности. Напряженность электрического поля равномерно заряженного шара максимальна на поверхности шара и убывает до нуля по мере приближения к центру. Поэтому чем меньше радиус R, тем больше сила, отталкивающая α-частицы.
Определение размеров атомного ядра
Резерфорд сделал вывод о том, что α-частица могла быть отброшена назад только случае, если положительный заряд атома и его масса сконцентрированы в небольшом пространстве. Так ученый пришел к мысли о существовании атомного ядра. По его представлению, это было тело малых размеров, в котором сконцентрирована почти вся масса и весь положительный заряд атома.
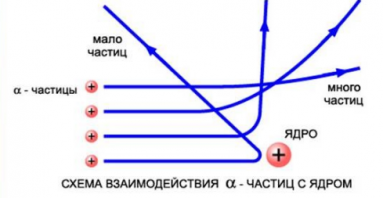
На рисунке выше изображены траектории α-частиц, пролетающих на различных расстояниях от ядра. Подсчитывая количество α-частиц, рассеянных на различные углы, Резерфорд дал оценку размерам ядра. Выяснилось, что его диаметр равен примерно 10–12–10–13 см. Такой разброс связан с тем, что размеры ядер атомов разных веществ различны. Размер же самого атома равен 10–8 см. Это в 10–100 тыс. раз больше размера атомного ядра.
Планетарная модель атома
Основываясь на результатах опыта, Резерфорд создал планетарную модель атома. Согласно ей, в центре атома расположено положительно заряженное ядро. В нем сосредоточена почти вся масса атома. Но в целом атом является нейтральной частицей. Это связано с тем, что положительный заряд ядра уравновешивается отрицательным зарядом электронов, которые вращаются вокруг этого ядра подобно тому, как вращаются планеты вокруг Солнца. Но если планеты вращаются под действием гравитационных сил, то электроны вращаются под действием сил кулоновских (со стороны ядра).
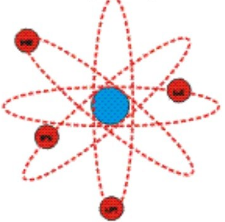
Так, в атоме водорода вокруг ядра вращается только лишь один электрон. Его ядро имеет положительный заряд, равный по модулю заряду электрона. Причем его масса примерно в 1836,1 раза больше массы электрона. Это ядро было названо протоном и стало рассматриваться как элементарная частица. Размер атома водорода определяется радиусом орбиты его электрона.
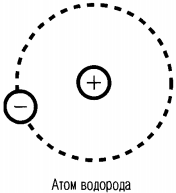
Простая и наглядная планетарная модель атома имеет прямое экспериментальное обоснование. Она кажется совершенно необходимой для объяснения опытов по рассеиванию α-частиц. Но даже это модель не объяснить факт существования атома, его устойчивость. Ведь движение электронов по орбитам происходит с ускорением, и оно очень велико. Ускоренно движущийся заряд по законам электродинамики Максвелла должен излучать электромагнитные волны с частотой, равной частоте его обращения вокруг ядра. Излучение сопровождается энергетическими потерями. Теряя энергию, электроны должны приближаться к ядру так, как спутник приближается к Земле при торможении о верхние слои атмосферы. По расчетам, электрон должен упасть на ядро за 10–8 с. Но этого не происходит. Атомы устойчивы и в невозбужденном состоянии могут существовать бесконечно. При этом они не излучают электромагнитные волны.