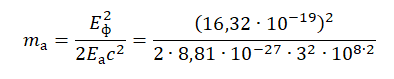Планетарная модель атома, предложенная Резерфордом, – это попытка применения классических представлений о движении тел к явлениям атомных масштабов. Она оказалась несостоятельной. Классический атом неустойчив. Электроны, движущиеся по орбите с ускорением, должны неизбежно упасть на ядро, растратив всю энергию на излучение электромагнитных волн (см. рисунок ниже). При этом спектр излучения атома должен быть непрерывным, а не линейчатым. Это никак не вязалось с тем, что ученые наблюдали на практике.
Следующий шаг в развитии представлений об устройстве атома в 1913 году сделал выдающийся датский физик Н. Бор. Проанализировав всю совокупность опытных фактов, Бор пришел к выводу, что при описании поведения атомных систем следует отказаться от многих представлений классической физики. Он сформулировал постулаты, которым должна удовлетворять новая теория о строении атомов.
Квантовые постулаты Бора – предположения (утверждения), сделанные Н. Бором для того, чтобы модель строения атома Резерфорда соответствовала реальному поведению атомов водорода.
Первый постулат Бора
Первый постулат Бора также носит название постулата стационарных состояний:
Атомная система может находиться только в стационарных, или квантовых, состояниях, каждому из которых соответствует определенная энергия En. В стационарном состоянии атом не излучает электромагнитные волны.
Этот постулат находится в явном противоречии с классической механикой, согласно которой энергия движущегося электрона может быть любой. Он находится в противоречии и с электродинамикой, так как допускает возможность ускоренного движения электронов без излучения электромагнитных волн.
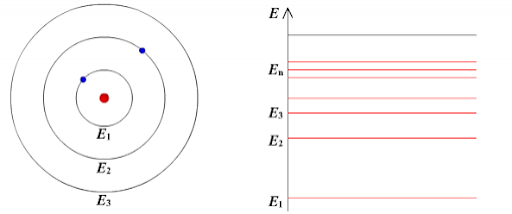
Согласно первому постулату Бора, атом характеризуется системой энергетических уровней, каждый из которых соответствует определенному стационарному состоянию (см. рисунок ниже). Механическая энергия электрона, движущегося по замкнутой траектории вокруг положительно заряженного ядра, отрицательна. Поэтому всем стационарным состояниям соответствуют значения энергии En < 0. При En ≥ 0 электрон удаляется от ядра, т. е. происходит ионизация. Величина |E1| называется энергией ионизации.
Второй постулат Бора
Второй постулат Бора также носит название правила частот:
Излучение света происходит при переходе атома из стационарного состояния с большей энергией Ek в стационарное состояние с меньшей энергией En. Энергия излученного фотона равна разности энергий стационарных состояний.
Разность энергий стационарных состояний можно вычислить по формуле:
E=hν
hνkn=Ek−En
Внимание! В квантовой физике энергию принято измерять не в Джоулях, а в электрон-вольтах, обозначаемых «эВ». 1 эВ равен энергии, приобретаемой электроном при прохождении разницы потенциалов 1 В. 1 эВ = 1,6∙10–19 Дж.
Отсюда можно выразить частоту излучения:
νkn=Ek−Enh
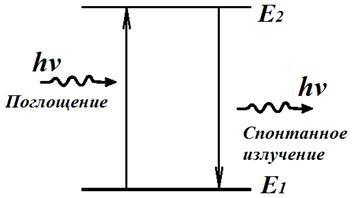
Наименьшей энергии En соответствует состояние атома, которое называется основным, а наибольшей энергии Ek — возбужденное состояние атома. В основном состоянии электрон может находиться неограниченно долго, а в остальных состояниях не более 10-8 с.
Если атом переходит из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией (Ek > En), происходит излучение фотона. Если атом переходит из стационарного состояния с меньшей энергией в стационарное состояние с большей энергией (Ek < En), происходит поглощение фотона.
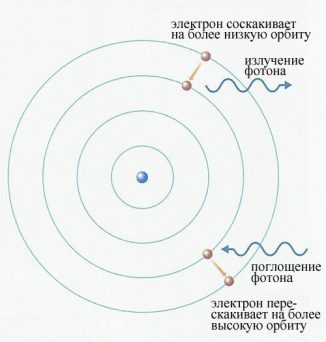
Второй постулат Бора позволил объяснить линейчатую структуру атомных спектров. Ведь атом, как оказалось, может поглощать и излучать свет только определенных частот.
Этот постулат Бора также противоречит электродинамике Максвелла, так как частота излучения определяется только изменением энергии атома и никак не зависит от характера движения электрона.
Пример №1. Определите длину волны света, испускаемого атомом водорода при его переходе из стационарного состояния с энергией E4 = –0,85 эВ (k = 4) в состояние с энергией E2 = –3,4 эВ (n = 2).
Длина волны определяется формулой:
λ=cν
Частоту найдем по формуле:
νkn=Ek−Enh
Следовательно, длина волны равна:
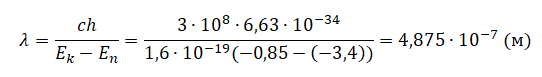
Теория Бора при описании поведения атомных систем не отвергла полностью законы классической физики. В ней сохранились представления об орбитальном движении электронов в кулоновском поле ядра. Классическая ядерная модель атома Резерфорда в теории Бора была дополнена идеей о квантовании электронных орбит. Поэтому теорию Бора иногда называют полуклассической.
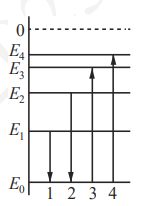 На рисунке изображена упрощённая диаграмма нижних энергетических уровней атома. Нумерованными стрелками отмечены некоторые возможные переходы атома между этими уровнями. Какие из этих четырёх переходов связаны с излучением света с наибольшей длиной волны и поглощением света с наименьшей энергией? Установите соответствие между процессами поглощения и излучения света и энергетическими переходами атома, указанными стрелками. К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
На рисунке изображена упрощённая диаграмма нижних энергетических уровней атома. Нумерованными стрелками отмечены некоторые возможные переходы атома между этими уровнями. Какие из этих четырёх переходов связаны с излучением света с наибольшей длиной волны и поглощением света с наименьшей энергией? Установите соответствие между процессами поглощения и излучения света и энергетическими переходами атома, указанными стрелками. К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.


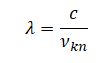
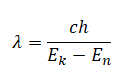
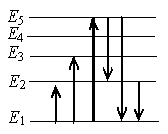 На рисунке представлен фрагмент диаграммы энергетических уровней атома. Какой из отмеченных стрелками переходов между энергетическими уровнями сопровождается излучением фотона с максимальной энергией?
На рисунке представлен фрагмент диаграммы энергетических уровней атома. Какой из отмеченных стрелками переходов между энергетическими уровнями сопровождается излучением фотона с максимальной энергией?